Zirkonium
| Chemisch element | |

| |
| Zirkonium kristallen | |
| Naam | Zirkonium van zurgun (Persisch) |
| Symbool | Zr |
| Atoomnummer | 40 |
| Soort | Overgangsmetaal |
| Kleur | Grijswit |
| Smeltpunt | 1855 oC |
| Kookpunt | 4377 oC |
| Portaal | |
|---|---|
Zirkonium is een chemisch element met het symbool Zr en atoomnummer 40 in het Periodiek Systeem va de scheikunde. De naam zirkonium is ontleend aan de naam van het mineraal zirkoon, de belangrijkste bron van zirkonium (het woord is verwant aan het Perzische zargun,of zar-gun, " goudachtig " of "als goud"). Het is een glanzend, grijswit, sterk overgangsmetaal dat sterk lijkt op hafnium en, in mindere mate, op titanium.
Voorkomen
Zirkoon, een kristal met zirkonium, komt veel voor in de aardkorst. Het komt voor als een algemeen bijkomend mineraal in stollingsgesteenten. Zirkoon wordt voornamelijk aangetroffen in Australië, Brazilië, India, Rusland, Zuid-Afrika en de Verenigde Staten.
Zirkonium vormt een verscheidenheid aan niet-organische en organometaalverbindingen zoals respectievelijk zirkoniumdioxide en zirkonoceendichloride. Het wordt niet in de natuur gevonden als een natuurlijk metaal. Van nature komen vijf zogeheten isotopen voor, waarvan er vier stabiel zijn. Zirkoniumverbindingen hebben geen bekende biologische rol. Zirkonium is een zacht, kneedbaar, smeedbaar metaal dat vast is bij kamertemperatuur, hoewel het hard en broos is bij lagere zuiverheden. In poedervorm is zirkonium licht ontvlambaar, maar de vaste vorm is veel minder vatbaar voor ontbranding. Zirkonium is zeer goed bestand tegen corrosie door zuren, zout water en andere middelen.
Zirkonium in erts of mineraal
Dit is een glanzend, Zirkoon gemmy, cognackleurig kristal van zirkoon dat is gegroeid op een suikerachtige, bruine matrix van calciet, een calcium-carbonaat (CaCO3).
Ilmeniet is een mineraal van titanium- ijzeroxide met de geïdealiseerde formule FeTiO3 met Zirkonium als bijproduct
Geschiedenis
Het zirkoniumhoudende mineraal zirkoon en verwante mineralen (jargoon, hyacint, jacinth, ligure) werden genoemd in bijbelse geschriften. Het was niet bekend tot 1789 dat het mineraal een nieuw element bevat, toen de chemicus Martin Heinrich Klaproth een jargoon mineraal bestuedeerde van het eiland Ceylon (nu Sri Lanka). Hij noemde het nieuwe element Zirkonerde (zirconia). Humphry Davy probeerde in 1808 dit nieuwe element te isoleren (apart te maken) door middel van elektrolyse, maar dat mislukte. Zirkoniummetaal werd voor het eerst in 1824 in onzuivere vorm gewonnen door Jons Jacob Berzelius door een mengsel van kalium en kaliumzirkoniumfluoride in een ijzeren buis te verhitten.
Het kristalstaafproces (ook bekend als het jodideproces ), ontdekt door Anton Eduard van Arkel en Jan Hendrik de Boer in 1925, was het eerste industriële proces voor de handelsproductie van metallisch zirkonium. De methode werd in 1945 vervangen door het veel goedkopere Kroll-proces ontwikkeld door William Justin Kroll, waarbij zirkoniumtetrachloride wordt gereduceerd door magnesium.
Gebruik
Zirkonium wordt voornamelijk gebruikt als vuurvast en dekkend middel, hoewel kleine hoeveelheden worden gebruikt als legeringsmiddel vanwege de sterke weerstand tegen corrosie. Het meeste zirkoon (het mineraal) wordt direct gebruikt in toepassingen bij hoge temperaturen. Omdat het vuurvast, hard en bestand is tegen chemische aantasting, vindt zirkoon vele toepassingen. Het wordt voornamelijk gebruikt als dekkend middel, waardoor keramische materialen een witte, ondoorzichtige uitstraling krijgen. Vanwege zijn chemische bestendigheid wordt zirkoon ook gebruikt in agressieve omgevingen, zoals mallen voor gesmolten metalen.
Zirkoniumdioxide (ZrO2) is een bestanddeel van sommige schuurmiddelen, zoals slijpstenen en schuurpapier.
Maar een klein deel van het zirkoon wordt omgezet in het metaal, dat verschillende toepassingen vindt. Vanwege de uitstekende weerstand tegen corrosie ("roest") van zirkonium, wordt het vaak gebruikt als legering-middel in materialen die worden blootgesteld aan agressieve omgevingen, zoals chirurgische apparaten, lichte filamenten (lange dunne draden) en horlogekasten.
Brandend zirkonium werd gebruikt als lichtbron in sommige fotografische flitslampen. Af en toe wordt het gebruikt in vuurwerk (helderwitte vonken).
Materialen gemaakt uit zirkoniummetaal en Zirkoniumdioxide (ZrO2) worden gebruikt in ruimtevoertuigen waar weerstand tegen hitte nodig is. Hoge temperatuur onderdelen zoals verbranders, bladen en schoepen in straalmotoren en stilstaande gasturbines worden in toenemende mate beschermd door dunne keramische lagen (soort glazuur), meestal samengesteld uit een mengsel van zirkoniumoxide en yttrium-oxide. Dergelijke keramische lagen worden ook aangebracht in buizen waarin chemicaliën worden getransporteerd.
Van zirkoniumoxide maken ze namaak-diamanten, die veel goedkoper zijn. Zirkoonkristallen worden in edelstenen gesneden voor gebruik in sieraden.
Biologie
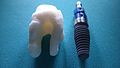
Zirkonium-houdende verbindingen worden in veel biomedische toepassingen, waaronder tandheelkundige implantaten en kronen, knie- en heupprothesen (kunst- knie en heup) en andere vervangende lichaamsonderdelen.
Het is ook een hulpmiddel voor mensen die een nierziekte hebben. Dit gebeurd dan bij een nierdialyse.
Hoewel zirkonium geen bekende biologische rol heeft, bevat het menselijk lichaam gemiddeld 250 milligram zirkonium en is de dagelijkse inname ongeveer 4,15 milligram, afhankelijk van de voedingsgewoonten. Zirkonium is wijd verspreid in de natuur en wordt aangetroffen in alle biologische systemen, bijvoorbeeld: in volkoren brood, bruine rijst, spinazie, eieren en in rundergehakt.
Verder wordt zirkonium vaak gebruikt in lichaamsverzorgingsproducten als deodorantsticks en deodorantsprays. Kortdurende blootstelling aan zirkoniumpoeder kan irritatie veroorzaken, maar alleen contact met de ogen vereist medische aandacht.
Veiligheid
Toepassingen
Antitransparant met aluminium zirkonium
Plaats in het periodiek systeem
| Periodiek systeem | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||